午前6:00から28名 (国内27名、海外1名) が参加して第7回webミーティングが行われました。東京慈恵会医科大学の山本修太郎さんが最新の研究成果を発表し、1時間にわたって活発な議論がなされました。
We usually have a meeting on the second Tuesday of the month.
2026 (Japan time)
Jan 13 Yokoo
Feb 10 Takasato
Mar 10 Yokokawa
Apr 14 Nishinakamura
May 12 Tanigawa
Jun 9 Yokoo
July no Zoom meeting (ISSCR on July 8-11)
Aug no Zoom meeting
Sep 8 Takasato
Oct 13 Yokokawa
Nov 10 Nishinakamura
Dec no Zoom meeting (annual meeting of Molecular Biology of Japan on Dec 1-4)
2025年12月5日に日本分子生物学会(横浜)で国際先導研究主催のシンポジウムを開催しました。
第48回日本分子生物学会年会ホームページ↓
https://www.aeplan.jp/mbsj2025/public_offering.html

26名が参加して第6回webミーティングが行われました。熊本大学発生研の谷川俊祐講師が最新の研究成果を発表し、活発な議論がなされました。
We usually have a meeting on the second Tuesday of the month.
(Japan time)
Apr 8 Nishinakamura
May 13 Yokoo
June 17 Takasato (3rd Tuesday to avoid overlap with ISSCR)
July no Zoom meeting (Kumamoto Retreat on July 26-27)
Aug no Zoom meeting
Sep 9 Yokokawa
Oct 14 Nishinakamura (switched from Tanigawa)
Nov 11 Tanigawa (switched from Nishinakamura)
Dec no Zoom meeting (please note the schedule change)
(Symposium at the annual meeting of the Molecular Biology of Japan in Yokohama on Dec 5)
Jan 13 Yokoo
Feb 10 Takasato
Mar 10 Yokokawa
本国際先導研究のメンバーであるJacob Hanna教授 (イスラエルWeizmann研究所)がHSFP Nakasone Awardを受賞しました。おめでとうございます!
https://www.hfsp.org/hfsp-nakasone-award/2025-jacob-yaqub-hanna
国内から27名、海外から2名が参加して第5回webミーティングが行われました。熊本大学の伊比裕太郎さん(現在鹿児島大学)が最新の研究成果を発表し、活発な議論がなされました。
We usually have a meeting on the second Tuesday of the month.
(Japan time)
Apr 8 Nishinakamura
May 13 Yokoo
June 17 Takasato (3rd Tuesday to avoid overlap with ISSCR)
July no Zoom meeting (Kumamoto Retreat on July 26-27)
Aug no Zoom meeting
Sep 9 Yokokawa
Oct 14 Nishinakamura (switched from Tanigawa)
Nov 11 Tanigawa (switched from Nishinakamura)
Dec no Zoom meeting (please note the schedule change)
(Symposium at the annual meeting of the Molecular Biology of Japan in Yokohama on Dec 5)
Jan 13 Yokoo
Feb 10 Takasato
Mar 10 Yokokawa
国内から28名、海外から3名が参加して第4回webミーティングが行われました。京都大学のCheng Ma特定助教が最新の研究成果を発表し、活発な議論がなされました。
We usually have a meeting on the second Tuesday of the month.
(Japan time)
Apr 8 Nishinakamura
May 13 Yokoo
June 17 Takasato (3rd Tuesday to avoid overlap with ISSCR)
July no Zoom meeting (Kumamoto Retreat on July 26-27)
Aug no Zoom meeting
Sep 9 Yokokawa
Oct 14 Nishinakamura (switched from Tanigawa)
Nov 11 Tanigawa (switched from Nishinakamura)
Dec 9 Yokoo
Jan 13 Takasato
Feb 10 Yokokawa
Mar 10 Tanigawa
表紙はこちら
論文内容はこちら
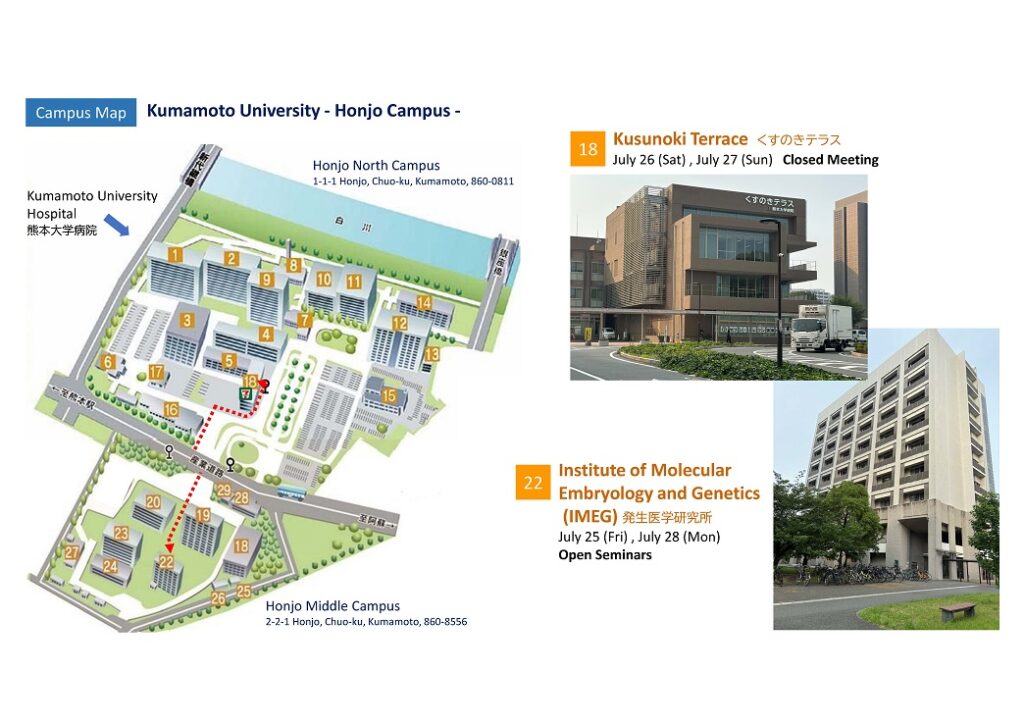
2025.7.25-28 熊本でリトリート(対面国際会議)及び発生研ジョイントセミナーを開催しました。
熊本大学クスノキテラスでにてリトリート(非公開の対面会議)を開催しました。国内外から40名(国内33名、米国4名、イスラエル2名、ドイツ1名)が熊本に集まり、14件の口頭発表と18件のポスター発表を行いました。これによって最先端の研究成果を共有し、活発な議論を行いました。また26名が阿蘇へのツアーに参加して交流を深めました。国内外の腎臓オルガノイド研究者が一堂に介した貴重な機会となりました。


その前後の7/25と7/28にはAndrew McMahon教授、Jacob Hanna教授、Ryuji Morizane准教授による公開のセミナー(発生研ジョイントセミナー)が開催され、学内の多くの研究者と交流しました。


Ola Shalaby, Tomoko Ohmori, Koichiro Miike, Shunsuke Tanigawa, Luh Ade Wilan Krisna, Alessia Calcagnì, Andrea Ballabio, Yoshiaki Kubota, Laura S. Schmidt, W. Marston Linehan, Takaaki Ito, Masaya Baba, Ryuichi Nishinakamura. Folliculin deletion in the mouse kidney results in cystogenesis of the loops of Henle via aberrant TFEB activation. The American Journal of Pathology, online (2025)
doi:https://doi.org/10.1016/j.ajpath.2025.05.010
[概要説明]
フォリキュリン(FLCN)は、腎嚢胞や癌を含む様々な症状を特徴とするBirt-Hogg-Dubé(BHD)症候群の原因遺伝子です。腎臓発生分野(西中村隆一教授)の大学院生Ola Shalabyさんらは、ネフロン特異的Flcnノックアウトマウスが、ネフロン全域にわたって嚢胞形成を示すことを見出しました。シングルセルRNAシークエンスにより、特にヘンレのループで多くの遺伝子が増加していることが明らかになりました。これらの遺伝子にはライソゾームやmTORC1活性化に関連する遺伝子が含まれ、TFE3/TFEBの標的と考えられました。そこでFlcn/Tfebのダブルノックアウトを作製したところ、症状のほとんどが消失しました。今回の報告は、ネフロンの発生、特にヘンレのループにおけるFLCN-TFEBシグナル伝達経路の重要な役割を明らかにしたもので、BHD症候群の病態解明や創薬に貢献することが期待されます。
本研究成果は、科学雑誌「The American Journal of Pathology」のオンライン版に6月9日に掲載されました。本研究は、文部科学省科学研究費補助金(基盤研究(S)、国際先導研究「腎臓を創る」)の支援を受けました。
[背景]
Birt-Hogg-Dubé(BHD)症候群は、腎嚢胞および腫瘍、良性皮膚丘疹、肺嚢胞、自然気胸等を特徴とする常染色体優性疾患であり、フォリキュリン(FLCN)はBHD症候群を引き起こす癌抑制遺伝子として知られています。
腎臓の最小機能単位であるネフロンは、それぞれが糸球体、近位尿細管、ヘンレのループ、遠位尿細管から構成されています。ヘンレのループは、皮質髄質軸に沿ったユニークなループ構造をしており、尿の濃縮に必須です。腎臓発生分野(西中村隆一教授)では腎臓発生に関係する遺伝子のノックアウトマウスを多数作ってきており、これが腎臓オルガノイド作製の基盤になっています。そこで今回はフォリキュリン(マウスの場合はFlcnと記載)に焦点をあてました。
[研究の内容]
ネフロン特異的Flcnノックアウトマウスを作製したところ、ネフロン全域、特にヘンレのループに多数の嚢胞が形成されました。ノックアウトマウスのほとんどは出生後まもなく死亡し、症状の軽いものだけが生き残りました。シングルセルRNAシークエンスにより、特にヘンレのループにおいて、多くの遺伝子が増加していることがわかりました。これらには、ライソゾームやmTORC1活性化に関連する遺伝子が多く含まれており、転写因子TFE3/TFEBの標的と考えられました。そこでFlcn/Tfe3のダブルノックアウトを作製しましたが、糸球体嚢胞が改善したのみでした。一方Flcn/Tfebのダブルノックアウトでは症状のほとんどが劇的に消失しました。したがって、Flcnの欠損はTFEBの異常な活性化を介して嚢胞形成を引き起こすことが明らかになりました(図)。
[成果・展開]
今回の報告は、ネフロンの発生、特にヘンレのループにおけるFLCN-TFEBシグナルの重要性を明らかにしたもので、BHD症候群の初期病態の解明に貢献することが期待されます。TFEB阻害剤はBHD患者に対する有望な治療法となるかもしれません。FLCNを欠損させたヒト腎臓オルガノイドは、このような治療法の有効性を調べるのに有用である可能性が出てきました。
[用語解説]
・ネフロン:腎臓の最小機能単位であり、それぞれが糸球体、近位尿細管、ヘンレのループ、遠位尿細管から構成されている。ヒト成人の腎臓には約100万個のネフロンが存在する。
・ヘンレのループ:皮質髄質軸に沿ったユニークなループ構造であり、尿の濃縮に必須。
・ライソゾーム:細胞内の小器官。この表面上でmTORCの活性化が起きる。
・mTORC: 細胞の増殖を制御する重要な分子
・TFEBとTFE3: ライソゾーム関連遺伝子などを制御する転写因子
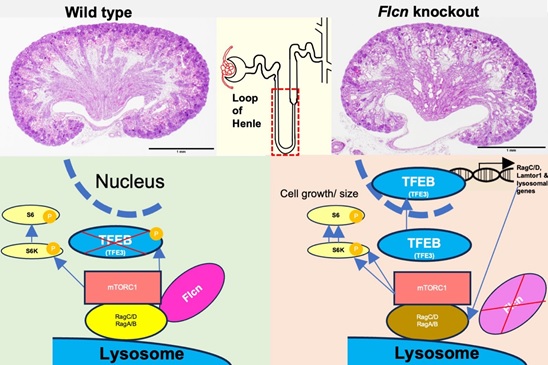
[図の説明]
Flcn-TFEBシグナルは腎臓における嚢胞形成に関与する
正常な状態では、FlcnはGTPase活性化タンパク質(GAP)として働き、RagC/DとRagA/B複合体を活性化する。この複合体は、mTORC1のリソソーム表面へのリクルートを促進し、活性化されたmTORC1はS6キナーゼを含む多くの基質をリン酸化する。同時にTFEBをリン酸化して不活性化する。しかしFlcnがない場合、RagC/Dは不活性なままであり、mTORC1を介してTFEBをリン酸化することはできない。リン酸化されていないTFEBは核に移動し、そこでRagC/D、Lamtor1、リソソーム生合成に関連する遺伝子など、標的遺伝子の転写を活性化する。これがmTORC1の過剰活性化を引き起こし、過剰な細胞増殖と嚢胞形成を引き起こす。(上記論文Shalaby et al.から改変)